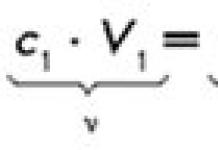Ang solubility ng mga compound sa parehong homologous series ay bumababa nang malaki sa pagtaas ng molekular na timbang, ito ay dahil sa ang katunayan na ang intermolecular na pwersa ng pakikipag-ugnayan ay tumaas.
Halimbawa, ang benzene ay ganap na nahahalo sa ethanol, habang ang ethanol at anthracene ay bahagyang nahahalo lamang. Ang epekto ng molekular na timbang sa pangkalahatang solubility ay lalong kapansin-pansin sa mga macromolecule. Halimbawa, ang acetone, alkohol, at puro acetic acid ay madaling matunaw ang styrene, ngunit hindi matunaw ang polystyrene; Ang vinyl acetate ay natutunaw nang walang mga problema sa mga eter at saturated hydrocarbons, ngunit hindi ito sinusunod sa polyvinyl acetate. Ang selulusa ay hindi natutunaw sa mga alkohol, ang polyethylene glycol ay hindi natutunaw sa mga eter, ang polyvinyl chloride ay hindi natutunaw sa vinyl chloride, at ang polyacrylonitrile ay hindi natutunaw sa acetonitrile, bagaman ang pagkakaroon ng isang kemikal na relasyon sa pagitan ng mga polimer at monomer na ito ay halata.
Dahil sa kanilang mataas na molekular na timbang, ang mga nakabalangkas na polimer ay hindi natutunaw sa mga solvent kahit na sa mataas na temperatura. Isa, nagagawa nilang bumukol sa pagkakaroon ng mga solvents, depende sa density at likas na katangian ng mga crosslink.
Sa mga solusyon, ang kabuuang ratio ng solvent sa solute ay nag-iiba. Kung ang dami ng solute na may kaugnayan sa solvent ay medyo malaki, kung gayon ang solusyon na ito ay tinatawag na puro. Kung hindi, ang solusyon na ito ay itinuturing na mahina.
Ang masa ng solusyon ay ang kabuuan ng mga masa ng solvent at solute. Halimbawa, kung ang 10 g ng asukal ay natunaw sa 100 g ng tubig, kung gayon ang masa ng buong solusyon ay magiging 110 g. Kapag naglalarawan ng anumang solusyon, ang konsentrasyon nito ay itinuturing na isang napakahalagang katangian, i.e. ilang porsyento ang solute sa solusyon. Halimbawa, kung ang mass ng solvent 647 ay 10 g, at ang mass ng solusyon ay 110 g, pagkatapos ay upang mahanap ang konsentrasyon ng 647 solvent, kailangan mong hatiin ang 10 g ng 110 g, at i-multiply ang resulta ng 100%. Samakatuwid, 10g/110g*100%=9.09%.
Ang konsentrasyon ng mga solusyon ay tumpak na naglalarawan ng mass fraction ng kabuuang solute (w) - ang ratio ng kabuuang masa ng solute sa masa ng solusyon. Dapat pansinin na ito ay ang ratio sa masa ng solusyon mismo, at hindi sa kabuuang masa ng solvent. Ang mass fraction ay ipinahayag bilang isang porsyento at sa mga fraction (isang walang sukat na halaga).
Kung ang masa ng solusyon ay 200 g, at ang masa ng solute sa solusyon na ito ay 50 g, kung gayon napakasimpleng kalkulahin ang mass fraction - 50/200 = 25% o 0.25. Madali ring mahanap ang mass fraction ng solvent mismo. Ito ay magiging katumbas ng 200-50 = 150 g, kaya 150/200 = 75% o 0.75.
Gawain.
Kalkulahin ang masa ng asin at tubig na kinakailangan upang maghanda ng 40 g ng NaCl solution na may mass fraction na 5%.
1. Isulat ang kalagayan ng problema gamit ang pangkalahatang tinatanggap na notasyon
m solusyon = 40g
1. Kalkulahin ang masa ng solute gamit ang formula:
m in-va \u003d ω ∙ m solusyon / 100%
m (NaCl) \u003d 5% 40g / 100% \u003d 2g
2. Hanapin ang masa ng tubig sa pamamagitan ng pagkakaiba sa pagitan ng masa ng solusyon at ang masa ng solute:
m r-la \u003d m r-ra - m in-va
m (H 2 O) \u003d 40g - 2g \u003d 38 g.
3. Isulat ang sagot.
Sagot: upang ihanda ang solusyon, kailangan mong kumuha ng 2g ng asin at 38g ng tubig.
Algorithm para sa paghahanap ng mass fraction ng isang solute kapag diluting (evaporating) ng isang solusyon
Gawain
m r-ra1 = 80g
m (H 2 O) \u003d 30g
1. Bilang resulta ng pagbabanto (pagsingaw) ng solusyon, ang mass ng solusyon ay tumaas (bumaba), at ang parehong halaga ng sangkap ay nanatili sa loob nito.
Kalkulahin ang masa ng solute sa pamamagitan ng pag-convert ng formula:
ω \u003d m in-va / m na solusyon ∙ 100%
m in-va \u003d ω 1 m r-ra1 / 100%
m in-va \u003d 15% 80g \u003d 12g
2. Kapag ang solusyon ay natunaw, ang kabuuang masa nito ay tumataas (kapag sumingaw, ito ay bumababa).
Hanapin ang masa ng bagong nakuha na solusyon:
m r-ra2 \u003d m r-ra1 + m (H 2 O)
m solusyon2 = 80g + 30g = 110g
3. Kalkulahin ang mass fraction ng solute sa bagong solusyon:
ω 2 \u003d m in-va / m r-ra2 ∙ 100%
ω 2 \u003d 12g / 110g 100% \u003d 10.9%
4. Isulat ang sagot
Sagot: ang mass fraction ng solute sa solusyon kapag natunaw ay 10.9%
Algorithm para sa paglutas ng mga problema ayon sa "panuntunan ng krus"
Upang makakuha ng solusyon na may ibinigay na mass fraction (%) ng isang solute sa pamamagitan ng paghahalo ng dalawang solusyon sa isang kilalang mass fraction ng isang solute, isang diagonal scheme ang ginagamit ("rule of the cross").
Ang kakanyahan ng pamamaraang ito ay ang mas maliit na isa ay ibinawas sa pahilis mula sa mas malaking halaga ng mass fraction ng solute.
Ang mga pagkakaiba (s-b) at (a-c) ay nagpapakita sa kung anong mga proporsyon ng solusyon a at b ang dapat kunin upang makakuha ng solusyon c.
Kung ang isang purong solvent, halimbawa, H 2 0, ay ginagamit para sa pagbabanto bilang paunang solusyon, kung gayon ang konsentrasyon nito ay kukunin bilang 0 at nakasulat sa kaliwang bahagi ng diagonal na diagram.
Gawain
Para sa paggamot ng mga kamay ng siruhano, mga sugat, postoperative field, yodo tincture na may mass fraction na 5% ay ginagamit. Sa anong mass ratio dapat paghaluin ang mga solusyon na may mass fraction ng yodo 2.5% at 30% upang makakuha ng 330 g ng iodine tincture na may mass fraction ng yodo 5%?
1. Isulat ang kalagayan ng problema gamit ang pangkalahatang tinatanggap na notasyon.
1. Gumawa ng "diagonal pattern". Upang gawin ito, isulat ang mga mass fraction ng mga unang solusyon sa ilalim ng isa, sa kaliwang bahagi ng krus, at sa gitna ang ibinigay na mass fraction ng solusyon.
2. Ibawas mula sa mas malaking bahagi ng masa ang mas maliit (30–5=25; 5–2.5=2.5) at hanapin ang mga resulta.
Isulat ang mga resulta na makikita sa kanang bahagi ng diagonal scheme: kung maaari, bawasan ang mga numerong nakuha. Sa kasong ito, ang 25 ay sampung beses na mas malaki kaysa sa 2.5, iyon ay, sa halip na 25 ay nagsusulat sila ng 10, sa halip na 2.5 ay nagsusulat sila ng 1.
Ang mga numero (sa kasong ito 25 at 2.5 o 10 at 1) ay tinatawag na mass number. Ang mga numero ng masa ay nagpapakita sa kung anong ratio ang kinakailangan upang kunin ang mga paunang solusyon upang makakuha ng isang solusyon na may mass fraction ng yodo na 5%.
3. Tukuyin ang masa ng 30% at 2.5% na solusyon gamit ang formula:
m p-ra \u003d bilang ng mga bahagi m 3 / kabuuan ng mga bahagi ng masa
m 1 (30%) \u003d 1 330g / 1 + 10 \u003d 30g
m 2 (2.5%) \u003d 10 330g / 1 + 10 \u003d 300g
4. Isulat ang sagot.
Sagot: upang maghanda ng 330 g ng isang solusyon na may mass fraction ng yodo na 5%, kinakailangang paghaluin ang 300 g ng isang solusyon na may mass fraction na 2.5% at 30 g na may mass fraction na 30%.
Mga kalkulasyon ng konsentrasyon
mga solute
sa mga solusyon
Ang paglutas ng mga problema para sa pagtunaw ng mga solusyon ay hindi partikular na mahirap, ngunit nangangailangan ng pangangalaga at ilang pagsisikap. Gayunpaman, posible na gawing simple ang solusyon ng mga problemang ito sa pamamagitan ng paggamit ng batas ng pagbabanto, na ginagamit sa analytical chemistry kapag nagti-titrate ng mga solusyon.
Ang lahat ng mga libro ng problema sa kimika ay nagpapakita ng mga solusyon sa mga problema na ipinakita bilang isang sample na solusyon, at lahat ng mga solusyon ay gumagamit ng batas ng pagbabanto, ang prinsipyo kung saan ay ang dami ng isang solute at ang masa. m mananatiling hindi nagbabago sa orihinal at diluted na solusyon. Kapag nalutas namin ang isang problema, isinasaisip namin ang kundisyong ito, at isinusulat namin ang pagkalkula sa mga bahagi at unti-unti, hakbang-hakbang, nilalapitan namin ang huling resulta.
Isaalang-alang ang problema sa paglutas ng mga problema sa pagbabanto batay sa mga sumusunod na pagsasaalang-alang.
Dami ng solute:
= c V,
saan c ay ang molar na konsentrasyon ng solute sa mol/l, V- ang dami ng solusyon sa l.
Masa ng solute m(r.v.):
m(r.v.) = m(r-ra),
saan m(p-ra) - ang masa ng solusyon sa g, - ang mass fraction ng solute.
Ipahiwatig natin sa inisyal (o undiluted) na solusyon ang mga dami c, V, m(r-ra), sa pamamagitan ng Sa 1 ,V 1 ,
m 1 (p-ra), 1, at sa isang dilute na solusyon - sa pamamagitan ng Sa 2 ,V 2 ,m 2 (r-ra), 2 .
Gawin natin ang mga equation ng dilution ng mga solusyon. Ang mga kaliwang bahagi ng mga equation ay kukunin para sa mga paunang (hindi diluted) na solusyon, at ang mga tamang bahagi - para sa mga dilute na solusyon.
Ang pare-pareho ng dami ng isang solute sa pagbabanto ay magkakaroon ng anyo:
![]()
Konserbasyon ng bigat m(r.v.):
![]()
Ang dami ng isang solute ay nauugnay sa masa nito m(r.v.) ratio:
= m(r.v.)/ M(r.v.),
saan M(r.v.) ay ang molar mass ng solute sa g/mol.
Ang mga equation ng dilution (1) at (2) ay magkakaugnay tulad ng sumusunod:
mula 1 V 1 = m 2 (r-ra) 2 / M(r.v.),
m 1 (r-ra) 1 = Sa 2 V 2 M(R.V.).
Kung ang dami ng natunaw na gas ay kilala sa problema V(gas), kung gayon ang dami ng sangkap nito ay nauugnay sa dami ng gas (n.o.) ayon sa ratio:
= V(gas)/22.4.
Ang mga equation ng pagbabanto ay kukuha ng anyo, ayon sa pagkakabanggit:
V(gas)/22.4 = Sa 2 V 2 ,
V(gas)/22.4 = m 2 (r-ra) 2 / M(gas).
Kung ang masa ng isang sangkap o ang dami ng isang sangkap na kinuha upang maghanda ng isang solusyon ay kilala sa problema, pagkatapos ay sa kaliwang bahagi ng dilution equation ay inilalagay m(r.v.) o , depende sa kondisyon ng problema.
Kung, ayon sa kondisyon ng problema, kinakailangan upang pagsamahin ang mga solusyon ng iba't ibang mga konsentrasyon ng parehong sangkap, kung gayon ang mga masa ng mga natunaw na sangkap ay summed sa kaliwang bahagi ng equation.
Kadalasan, sa mga gawain, ginagamit ang density ng solusyon (g / ml). Ngunit dahil ang molar concentration Sa sinusukat sa mol / l, pagkatapos ay ang density ay dapat ipahayag sa g / l, at ang lakas ng tunog V- sa l.
Magbigay tayo ng mga halimbawa ng paglutas ng mga "huwarang" problema.
Gawain 1. Anong dami ng 1M sulfuric acid solution ang dapat kunin upang makakuha ng 0.5 l ng 0.1M H2SO4 ?
Ibinigay:
c 1 \u003d 1 mol / l,
V 2 = 0.5 l,
Sa 2 = 0.1 mol/l.
Hanapin:
Solusyon
V 1 Sa 1 =V 2 Sa 2 ,
V 1 1 \u003d 0.5 0.1; V 1 = 0.05 l, o 50 ml.
Sagot.V 1 = 50 ml.
Gawain 2
(,
№ 4.23). Tukuyin ang masa ng solusyon na may mass fraction(CuSO 4) 10% at ang masa ng tubig na kakailanganin para maghanda ng solusyon na tumitimbang ng 500 g na may mass fraction
(CuSO 4) 2%.
Ibinigay:
1 = 0,1,
m 2 (r-ra) = 500 g,
2 = 0,02.
Hanapin:
m 1 (r-ra) =?
m(H 2 O) \u003d?
Solusyon
m 1 (r-ra) 1 = m 2 (r-ra) 2,
m 1 (r-ra) 0.1 \u003d 500 0.02.
Mula rito m 1 (r-ra) \u003d 100 g.
Hanapin ang masa ng idinagdag na tubig:
m(H 2 O) = m 2 (r-ra) - m 1 (r-ra),
m (H 2 O) \u003d 500 - 100 \u003d 400 g.
Sagot. m 1 (r-ra) \u003d 100 g, m(H 2 O) \u003d 400 g.
Gawain 3
(,
№ 4.37).Ano ang volume ng isang solusyon na may mass fraction ng sulfuric acid na 9.3%
(\u003d 1.05 g / ml) ay kinakailangan upang maghanda ng 0.35 M solusyon H2SO4 40 ml?
Ibinigay:
1 = 0,093,
1 = 1050 g/l,
Sa 2 = 0.35 mol/l,
V 2 = 0.04 l,
M(H 2 SO 4) \u003d 98 g / mol.
Hanapin:
Solusyon
m 1 (r-ra) 1 = V 2 Sa 2 M(H 2 SO 4),
V 1 1 1 = V 2 Sa 2 M(H2SO4).
Pinapalitan namin ang mga halaga ng mga kilalang dami:
V 1 1050 0.093 = 0.04 0.35 98.
Mula rito V 1 \u003d 0.01405 l, o 14.05 ml.
Sagot. V 1 = 14.05 ml.
Gawain 4
. Anong volume ng hydrogen chloride (N.O.) at tubig ang kakailanganin para makapaghanda ng 1 litro ng solusyon (\u003d 1.05 g / cm 3), kung saan ang nilalaman ng hydrogen chloride sa mga mass fraction ay 0.1
(o 10%)?
Ibinigay:
V (solusyon) \u003d 1 l,
(solusyon) = 1050 g/l,
= 0,1,
M(HCl) = 36.5 g/mol.
Hanapin:
V(HCl) = ?
m(H 2 O) \u003d?
Solusyon
V(HCl)/22.4 = m(p-ra) / M(HCl)
V(HCl)/22.4 = V(r-ra) (r-ra) / M(HCl)
V(HCl)/22.4 = 1 1050 0.1/36.5.
Mula rito V(HCl) = 64.44 litro.
Hanapin ang masa ng idinagdag na tubig:
m(H 2 O) = m(r-ra) - m(HCl),
m(H 2 O) = V(r-ra) (r-ra) - V(HCl)/22.4 M(HCl)
m (H 2 O) \u003d 1 1050 - 64.44 / 22.4 36.5 \u003d 945 g.
Sagot. 64.44 L HCl at 945 g tubig.
Gawain 5 (, № 4.34). Tukuyin ang konsentrasyon ng molar ng isang solusyon na may mass fraction ng sodium hydroxide na 0.2 at isang density na 1.22 g/ml.
Ibinigay:
0,2,
= 1220 g/l,
M(NaOH) = 40 g/mol.
Hanapin:
Solusyon
m(p-ra) = Sa V M(NaOH),
m(p-ra) = Sa m(r-ra) M(NaOH)/.
Hatiin ang magkabilang panig ng equation sa pamamagitan ng m(r-ra) at palitan ang mga numerical na halaga ng mga dami.
0,2 = c 40/1220.
Mula rito c= 6.1 mol/l.
Sagot. c= 6.1 mol/l.
Gawain 6 (, № 4.30).Tukuyin ang konsentrasyon ng molar ng solusyon na nakuha sa pamamagitan ng pagtunaw ng sodium sulfate na tumitimbang ng 42.6 g sa tubig na tumitimbang ng 300 g, kung ang density ng nagresultang solusyon ay 1.12 g/ml.
Ibinigay:
m (Na 2 SO 4) \u003d 42.6 g,
m(H 2 O) \u003d 300 g,
= 1120 g/l,
M(Na 2 SO 4) \u003d 142 g / mol.
Hanapin:
Solusyon
m(Na 2 SO 4) = Sa V M(Na2SO4).
500 (1 – 4,5/(4,5 + 100)) = m 1 (r-ra) (1 - 4.1 / (4.1 + 100)).
Mula rito m 1 (solusyon) \u003d 104.1 / 104.5 500 \u003d 498.09 g,
m(NaF) = 500 - 498.09 = 1.91 g.
Sagot. m(NaF) = 1.91 g.
PANITIKAN
1.Khomchenko G.P., Khomchenko I.G. Mga gawain sa kimika para sa mga mag-aaral sa unibersidad. M.: Bagong alon, 2002.
2. Feldman F.G., Rudzitis G.E. Chemistry-9. M.: Enlightenment, 1990, p. 166.
Mass fraction tinatawag na ratio ng masa ng isang ibinigay na bahagi m (X) sa masa ng buong solusyon M (p-ra). Ang mass fraction ay tinutukoy ng simbolong ω (omega) at ipinahayag sa mga fraction ng isang yunit o bilang isang porsyento:
ω (X) \u003d m (X) / M (r-ra) (sa mga fraction ng isang yunit);
ω (X) \u003d m (X) 100 / M (p-ra) (sa porsyento).
Ang konsentrasyon ng molar ay ang dami ng solute sa 1 litro ng solusyon. Ito ay tinutukoy ng simbolo c (X) at sinusukat sa mol / l:
c(X) = n(X)/V = m(X)/M(X) V.
Sa formula na ito, ang n(X) ay ang dami ng substance X na nakapaloob sa solusyon, ang M(X) ay ang molar mass ng substance X.

Isaalang-alang natin ang ilang karaniwang gawain.
- Tukuyin ang masa ng sodium bromide na nakapaloob sa 300 g ng isang 15% na solusyon.
Solusyon.
Ang masa ng sodium bromide ay tinutukoy ng formula: m (NaBr) \u003d ω M (p-ra) / 100;
m(NaBr) = 15 300/100 = 45 g.
Sagot: 45
2. Ang masa ng potassium nitrate na dapat matunaw sa 200 g ng tubig upang makakuha ng 8% na solusyon ay ______ g. (Bilogin ang iyong sagot sa pinakamalapit na buong numero.)
Solusyon.
Hayaan ang m(KNO 3) = x r, pagkatapos M(p-ra) = (200 + x) r.
Mass fraction ng potassium nitrate sa solusyon:
ω (KNO 3) \u003d x / (200 + x) \u003d 0.08;
x = 16 + 0.08x;
0.92x = 16;
x = 17.4.
Pagkatapos bilugan ang x = 17 g.
Sagot: 17 y.
3. Ang masa ng calcium chloride na dapat idagdag sa 400 g ng 5% na solusyon ng parehong asin upang doblehin ang mass fraction nito ay ______ g. (Isulat ang sagot sa pinakamalapit na ikasampu.)
Solusyon.
Ang masa ng CaCl 2 sa paunang solusyon ay:
m (CaCl 2) \u003d ω M (solusyon);
m (CaCl 2) \u003d 0.05 400 \u003d 20 g.
Ang mass fraction ng CaCl 2 sa huling solusyon ay ω 1 = 0.05 2 = 0.1.
Hayaang ang masa ng CaCl 2 na idaragdag sa paunang solusyon ay x g.
Pagkatapos ang masa ng pangwakas na solusyon M 1 (r-ra) \u003d (400 + x) g.
Mass fraction ng CaCl 2 sa huling solusyon:
Ang paglutas ng equation na ito, makakakuha tayo ng x \u003d 22.2 g.
Sagot: 22.2
4. Ang masa ng alkohol na kailangang sumingaw mula sa 120 g ng 2% alcoholic solution ng iodine upang mapataas ang konsentrasyon nito sa 5% ay _____________ g. (Isulat ang sagot sa pinakamalapit na ikasampu.)
Solusyon.
Tukuyin ang masa ng yodo sa paunang solusyon:
m (I 2) \u003d ω M (r-ra);
m (I 2) \u003d 0.02 120 \u003d 2.4 g,
Pagkatapos ng pagsingaw, ang masa ng solusyon ay naging katumbas ng:
M 1 (r-ra) \u003d m (I 2) / ω 1
M 1 (r-ra) \u003d 2.4 / 0.05 \u003d 48 g.
Sa pamamagitan ng pagkakaiba sa masa ng mga solusyon, nakita namin ang masa ng evaporated alcohol: 120-48 \u003d 72 g.
Sagot: 72
5. Ang masa ng tubig na dapat idagdag sa 200 g ng 20% sodium bromide solution upang makakuha ng 5% na solusyon ay _________ g. (Bilogin ang iyong sagot sa pinakamalapit na buong numero.)
Solusyon.
Tukuyin ang masa ng sodium bromide sa paunang solusyon:
m(NaBr) = ω M(r-ra);
m (NaBr) \u003d 0.2 200 \u003d 40 g.
Hayaang ang masa ng tubig na idaragdag upang palabnawin ang solusyon ay x g, pagkatapos ay ayon sa kondisyon ng problema:
Mula dito nakukuha namin ang x = 600 g.
Sagot: 600
6. Ang mass fraction ng sodium sulfate sa isang solusyon na nakuha sa pamamagitan ng paghahalo ng 200 g ng 5% at 400 g ng 10% na solusyon ng Na 2 SO 4 ay katumbas ng _____________%. (Bilugan ang iyong sagot sa ikasampu.)
Solusyon.
Tukuyin ang masa ng sodium sulfate sa unang paunang solusyon:
m 1 (Na 2 SO 4) \u003d 0.05 200 \u003d 10 g.
Tukuyin ang masa ng sodium sulfate sa pangalawang paunang solusyon:
m 2 (Na 2 SO 4) \u003d 0.1 400 \u003d 40 g.
Tukuyin natin ang masa ng sodium sulfate sa panghuling solusyon: m (Na 2 SO 4) \u003d 10 + 40 \u003d 50 g.
Tukuyin natin ang masa ng pangwakas na solusyon: M (p-ra) \u003d 200 + 400 \u003d 600 g.
Tukuyin natin ang mass fraction ng Na 2 SO 4 sa huling solusyon: 50/600 = 8.3%
Sagot: 8,3%.
Bilang karagdagan sa paglutas ng mga problema para sa mga solusyon:
Ang "panuntunan ng krus" ay ang diagonal na pamamaraan ng paghahalo ng panuntunan para sa mga kaso na may dalawang solusyon.
http://pandia.ru/text/78/476/images/image034_1.jpg" alt="" lapad="400" taas="120">
Timbang ng isang bahagi: 300/50 = 6 g.
Pagkatapos
m1 = 6 15 = 90 g, .
m2 = 6 35 = 210 g.
Kinakailangan na paghaluin ang 90 g ng isang 60% na solusyon at 210 g ng isang 10% na solusyon.
Gawain 3.1. Tukuyin ang masa ng tubig sa 250 g ng isang 10% sodium chloride solution.
Solusyon. Mula sa w \u003d m in-va / m na solusyon hanapin ang masa ng sodium chloride:
m in-va \u003d w m solusyon \u003d 0.1 250 g \u003d 25 g NaCl
Dahil ang m r-ra = m in-va + m r-la, pagkatapos ay makukuha natin:
m (H 2 0) \u003d m solusyon - m in-va \u003d 250 g - 25 g \u003d 225 g H 2 0.
Gawain 3.2. Tukuyin ang masa ng hydrogen chloride sa 400 ml ng hydrochloric acid solution na may mass fraction na 0.262 at isang density na 1.13 g/ml.
Solusyon. Dahil ang w = m in-va / (V ρ), pagkatapos ay makukuha natin:
m in-va \u003d w V ρ \u003d 0.262 400 ml 1.13 g / ml \u003d 118 g
Gawain 3.3. Sa 200 g ng isang 14% na solusyon sa asin ay idinagdag 80 g ng tubig. Tukuyin ang mass fraction ng asin sa nagresultang solusyon.
Solusyon. Hanapin ang masa ng asin sa orihinal na solusyon:
m asin \u003d w m solusyon \u003d 0.14 200 g \u003d 28 g.
Ang parehong masa ng asin ay nanatili sa bagong solusyon. Hanapin ang masa ng bagong solusyon:
m solusyon = 200 g + 80 g = 280 g.
Hanapin ang mass fraction ng asin sa nagresultang solusyon:
w \u003d m asin / m solusyon \u003d 28 g / 280 g \u003d 0.100.
Gawain 3.4. Anong dami ng 78% sulfuric acid solution na may density na 1.70 g/ml ang dapat kunin upang maghanda ng 500 ml ng 12% sulfuric acid solution na may density na 1.08 g/ml?
Solusyon. Para sa unang solusyon mayroon kami:
w 1 \u003d 0.78 At ρ 1 \u003d 1.70 g / ml.
Para sa pangalawang solusyon mayroon kami:
V 2 \u003d 500 ml, w 2 \u003d 0.12 At ρ 2 \u003d 1.08 g / ml.
Dahil ang pangalawang solusyon ay inihanda mula sa una sa pamamagitan ng pagdaragdag ng tubig, ang mga masa ng sangkap sa parehong mga solusyon ay pareho. Hanapin ang masa ng sangkap sa pangalawang solusyon. Mula sa w 2 \u003d m 2 / (V 2 ρ 2) meron kami:
m 2 \u003d w 2 V 2 ρ 2 \u003d 0.12 500 ml 1.08 g / ml \u003d 64.8 g.
m 2 \u003d 64.8 g. Nahanap namin
ang dami ng unang solusyon. Mula sa w 1 = m 1 / (V 1 ρ 1) meron kami:
V 1 \u003d m 1 / (w 1 ρ 1) \u003d 64.8 g / (0.78 1.70 g / ml) \u003d 48.9 ml.
Gawain 3.5. Anong dami ng isang 4.65% sodium hydroxide solution na may density na 1.05 g/ml ang maaaring ihanda mula sa 50 ml ng isang 30% sodium hydroxide solution na may density na 1.33 g/ml?
Solusyon. Para sa unang solusyon mayroon kami:
w 1 \u003d 0.0465 At ρ 1 \u003d 1.05 g / ml.
Para sa pangalawang solusyon mayroon kami:
V 2 \u003d 50 ml, w 2 \u003d 0.30 At ρ 2 \u003d 1.33 g / ml.
Dahil ang unang solusyon ay inihanda mula sa pangalawa sa pamamagitan ng pagdaragdag ng tubig, ang mga masa ng sangkap sa parehong mga solusyon ay pareho. Hanapin ang masa ng sangkap sa pangalawang solusyon. Mula sa w 2 \u003d m 2 / (V 2 ρ 2) meron kami:
m 2 \u003d w 2 V 2 ρ 2 \u003d 0.30 50 ml 1.33 g / ml \u003d 19.95 g.
Ang masa ng sangkap sa unang solusyon ay katumbas din ng m 2 \u003d 19.95 g.
Hanapin ang dami ng unang solusyon. Mula sa w 1 = m 1 / (V 1 ρ 1) meron kami:
V 1 \u003d m 1 / (w 1 ρ 1) \u003d 19.95 g / (0.0465 1.05 g / ml) \u003d 409 ml.
Solubility coefficient (solubility) - ang maximum na masa ng isang substance na natutunaw sa 100 g ng tubig sa isang naibigay na temperatura. Ang saturated solution ay isang solusyon ng isang substance na nasa equilibrium sa umiiral na precipitate ng substance na iyon.
Suliranin 3.6. Ang solubility coefficient ng potassium chlorate sa 25 °C ay 8.6 g. Tukuyin ang mass fraction ng asin na ito sa isang saturated solution sa 25 °C.
Solusyon. 8.6 g ng asin ang natunaw sa 100 g ng tubig.
Ang masa ng solusyon ay:
m solusyon \u003d m tubig + m asin \u003d 100 g + 8.6 g \u003d 108.6 g,
at ang mass fraction ng asin sa solusyon ay katumbas ng:
w \u003d m asin / m solusyon \u003d 8.6 g / 108.6 g \u003d 0.0792.
Suliranin 3.7. Ang mass fraction ng asin sa isang potassium chloride solution na saturated sa 20 °C ay 0.256. Tukuyin ang solubility ng asin na ito sa 100 g ng tubig.
Solusyon. Hayaan ang solubility ng asin X g sa 100 g ng tubig.
Kung gayon ang masa ng solusyon ay:
m solusyon = m tubig + m asin = (x + 100) g,
at ang mass fraction ay:
w \u003d m asin / m solusyon \u003d x / (100 + x) \u003d 0.256.
Mula rito
x = 25.6 + 0.256x; 0.744x = 25.6; x = 34.4 g bawat 100 g ng tubig.
Konsentrasyon ng molar Sa- ang ratio ng dami ng solute v (mol) sa dami ng solusyon V (sa litro), c \u003d v (mol) / V (l), c \u003d m in-va / (M V (l)).
Ang konsentrasyon ng molar ay nagpapakita ng bilang ng mga moles ng isang sangkap sa 1 litro ng solusyon: kung ang solusyon ay decimolar ( c = 0.1 M = 0.1 mol/l) ay nangangahulugan na ang 1 litro ng solusyon ay naglalaman ng 0.1 mol ng sangkap.
Suliranin 3.8. Tukuyin ang masa ng KOH na kinakailangan upang maghanda ng 4 na litro ng isang 2 M na solusyon.
Solusyon. Para sa mga solusyon na may konsentrasyon ng molar, mayroon kaming:
c \u003d m / (M V),
saan Sa- konsentrasyon ng molar,
m- ang masa ng sangkap,
M ay ang molar mass ng substance,
V- ang dami ng solusyon sa litro.
Mula rito
m \u003d c M V (l) \u003d 2 mol / l 56 g / mol 4 l \u003d 448 g KOH.
Suliranin 3.9. Ilang ml ng isang 98% na solusyon ng H 2 SO 4 (ρ = 1.84 g / ml) ang dapat kunin upang maghanda ng 1500 ml ng isang 0.25 M na solusyon?
Solusyon. Ang gawain ng diluting ang solusyon. Para sa isang puro solusyon mayroon kaming:
w 1 \u003d m 1 / (V 1 (ml) ρ 1).
Hanapin ang dami ng solusyon na ito V 1 (ml) \u003d m 1 / (w 1 ρ 1).
Dahil ang isang dilute na solusyon ay inihanda mula sa isang puro sa pamamagitan ng paghahalo ng huli sa tubig, ang masa ng sangkap sa dalawang solusyon na ito ay magiging pareho.
Para sa isang dilute na solusyon mayroon kaming:
c 2 \u003d m 2 / (M V 2 (l)) At m 2 \u003d s 2 M V 2 (l).
Pinapalitan namin ang nahanap na halaga ng masa sa expression para sa dami ng puro solusyon at isinasagawa ang mga kinakailangang kalkulasyon:
V 1 (ml) \u003d m / (w 1 ρ 1) \u003d (s 2 M V 2) / (w 1 ρ 1) \u003d (0.25 mol / l 98 g / mol 1.5 l) / (0.98 1.84 g / ml) \u004.